揭示庆大霉素生物合成中双脱氧修饰的过程和催化机理
9月26日,从武汉大学获悉,该校药学院邓子新院士团队孙宇辉教授课题组与英国剑桥大学、巴西圣保罗大学关于庆大霉素双脱氧催化机制的最新合作研究成果在《美国化学会催化》发表。论文通过遗传学、生物化学和结构生物学等多学科研究方法,成功揭示庆大霉素生物合成中双脱氧修饰的过程和催化机理,完成了曾经抗感染明星药物庆大霉素复杂生物合成途径的最后一块“拼图”。
庆大霉素作为氨基糖苷类抗生素的典型代表,曾一度是治疗革兰氏阴性细菌感染的首选药物。
伴随着日益严重的抗生素耐药性问题,及庆大霉素自身的肾毒性和耳毒性,如何通过合成生物学方法研制出更高效、更安全的庆大霉素等新型氨基糖苷类药物,成为人们的迫切愿望。
为此,彻底清晰的阐明其生物合成途径,尤其是对赋予了庆大霉素对抗部分钝化酶特性的C-3’和C-4’的双脱氧分子结构的形成机制,是对其进行理性改造的重要基础与前提,一直吸引着人们好奇和探索的目光。
在前期系统研究积累基础上,孙宇辉课题组通过对可能涉及双脱氧的PLP依赖的转氨酶候选编码基因进行体内遗传敲除,证实了GenB3和GenB4参与该过程,并通过鉴定的数个中间产物,说明该过程实际上包括连续的脱双羟基和双键还原步骤。再经GenB3和GenB4重组表达,并以分离获得的中间产物为底物进行严格体外生化验证,发现脱双羟基并非单一反应,除磷酸化酶GenP负责中间体磷酸化之外,还包含了连续的脱磷酸、异构化、脱氨基和转氨过程,而这些复杂变化均由GenB3单独催化完成。
同时,GenB4主导的双键还原并未使用还原型辅酶,而是非常规地通过亚氨基水解,间接实现了还原,再通过GenB3转氨,得到最终庆大霉素C组分产物。这个过程因为不同寻常的还原方式,在同一位点反复脱氨或转氨多达四次。整个催化过程在简单的表象之下蕴藏着自然界天然产物独特而精彩的催化机理。
课题组还发现,GenB3和GenB4虽然氨基酸序列极其相似,功能却不尽相同。通过对其蛋白晶体的结构解析,表明GenB3中第57位的Ser和GenB4中第52位Asp可能是引发其功能不同的关键所在,即仅仅一个氨基酸位点不同,最终决定了两者功能巨大差异。
据悉,论文题目为《庆大霉素生物合成中双脱氧的机理研究》,武汉大学李思聪、圣保罗大学Priscila Dos Santos Bury和剑桥大学的黄方吕为并列第一作者。本研究得到国家重点研发计划和国家自然科学基金国际(地区)合作与交流重点项目的资助。(记者 吴纯新 通讯员 姚苑)
责任编辑:kj005
文章投诉热线:156 0057 2229 投诉邮箱:29132 36@qq.com太空“快递”从文昌卫星发射中心出发 踏上空间站运送旅途
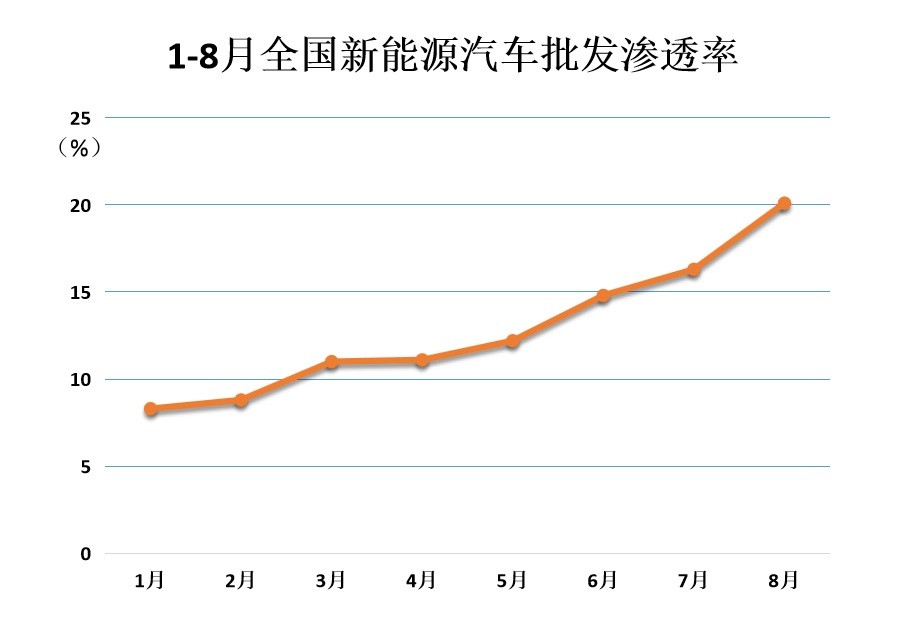
8月新能源车厂商批发渗透率突破20% 比亚迪市占率突破20%
神舟十二号载人飞船与空间站天和核心舱成功实施分离
长三乙火箭时隔16天再出征 中星9B顺利送入预订轨道
比亚迪新能源汽车销量和全球排名双创新高
我国科研成果产出显著增加 国家创新能力快速提升
相关新闻
最新资讯
OPPO Watch Free智能手表正式发布,让健康睡眠常伴你我
9月26日,在OPPO未来玩机发布会上,全新的超能睡手表OPPO Watch Free正式发布。OPPO Watch Free以OS...