强效!东盟制药阿达格拉西布上市!
老挝东盟制药(TLPH)全新款KRAS抑制剂——阿达格拉西布(Adagrasib)近日正式上市销售,为 KRAS G12C 突变的癌症患者提供治疗新选择!
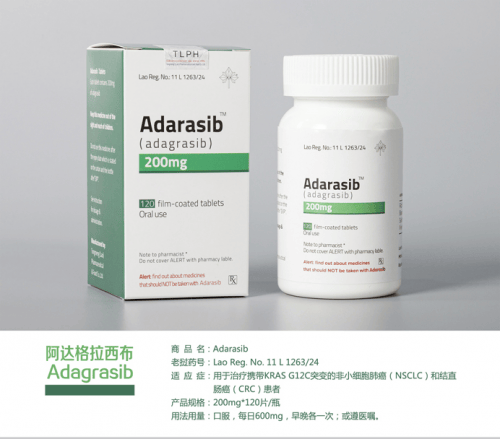
东盟制药(TLPH)阿达格拉西布(Adagrasib)于2024年12月16日正式获得老挝卫生部食品药品司(FDD)批准,其商品名为Adarasib,片剂,规格为200mg*120片/瓶。这是继索托拉西布(Sotorasib)2023年7月上市后,东盟制药出品的第二款KRAS抑制剂。

阿达格拉西布(Adagrasib)由美国Mirati公司研发,是一种针对KRAS G12C突变的高选择性口服小分子抑制剂,也是全球第二款获批的KRAS抑制剂。2022年12月13日,阿达格拉西布(Adagrasib)获FDA加速批准,用于治疗携带KRAS G12C突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者。2024年6月,FDA加速批准其联合西妥昔单抗(Cetuximab)用于治疗KRAS G12C突变的结直肠癌(CRC)患者。
针对非小细胞肺癌(NSCLC)患者的KRYSTAL-1临床试验数据表明,患者整体缓解率(ORR)达到了 43%,中位缓解持续时间(DOR)长达 8.5 个月。在 KRYSTAL - 1 试验的 Ⅰb 期和 Ⅱ 期综合分析中,接受每天 2 次 600mg剂量阿达格拉西布治疗的患者,ORR提升至 44%,疾病控制率(DCR)高达 81%;DOR进一步延长至 12.5 个月,中位总生存期(OS)也达到了 14.1 个月。在针对 33 例脑转移患者的试验中,颅内病灶ORR为 33.3%,为肺癌脑转移患者带来了希望。
在针对KRAS G12C突变型结直肠癌(CRC)患者的KRYSTAL-1 的 1/2 期试验,阿达格拉西布和西妥昔单抗联合治疗的ORR 为 46%,这意味着近一半的患者肿瘤显著缩小30%以上。更值得一提的是,所有的28名患者病情均控制稳定或肿瘤出现不同程度的缩小,DCR高达100%!
根据美国临床肿瘤学会(ASCO)胃肠道肿瘤研讨会上公布的Ⅱ期KRYSTAL-1试验最新数据,在涵盖了包括胆道癌、阑尾癌、小肠癌、胃食道结合部癌、食道癌以及胰腺导管腺癌在内的多类消化道肿瘤等实体瘤中,阿达格拉西布显示出广谱抗癌的非凡实力。
上述数据显示,27例可评估的患者,ORR为41%, DCR高达100%,即全部受试患者均达到了临床疾病稳定。在10例胰腺癌患者当中,ORR为50%,DOR为7.0个月,无进展生存期(PFS)为6.6个月;其它患者的ORR为35%,DOR为7.9个月,PFS为7.9个月。

在肺癌药物领域,依靠深厚的技术沉淀和丰富的数据积累,东盟制药(TLPH)迄今已经成功仿制包括阿达格拉西布(Adagrasib)在内的十款核心药物,形成了针对肺癌治疗的产品矩阵和“一站式”产品服务,彰显其在该战略性产品领域的实力优势和品牌效应!
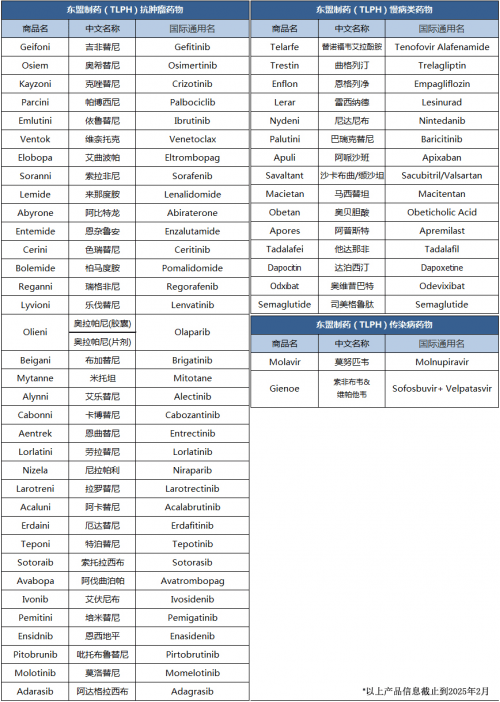

作为老挝境内成立时间最长、规模最大的仿制药企,东盟制药(TLPH)现有获批的药品超过50款,涉及肿瘤、慢性病、传染病、男性健康等领域。2025年伊始,东盟制药将坚定投入全球领先、优质药物的研发与生产,持续为“一带一路”沿线各国患者提供“安全、高效、经济可负担”的优质药物解决方案,服务沿线各国公共健康福祉!
免责声明:市场有风险,选择需谨慎!此文仅供参考,不作买卖依据。
责任编辑:kj005





